Personalizovaná medicína
Personalizovaná (PM), alebo označovaná aj ako „precízna“ terapia predstavuje najvyšší možný individuálny prístup v diagnostike, liečbe a manažmente pacienta s onkologickým ochorením. Umožňuje transformovať zdravotnú starostlivosť pre potrebu individuálnej diagnostiky a liečby pacienta (1).
Hlavným cieľom PM je ponúknuť pacientovi oveľa precíznejšiu a cielenejšiu diagnostiku jeho ochorenia a nastavenie pacienta na individuálnu cielenú liečbu s čo najvyšším účinkom a najnižšou mierou vedľajších vplyvov liečby (2).

Individuálne nastavenie Onkologickej liečby
Pre našich klientov a pacientov prinášame nové možnosti personalizovanej liečby (individuálne nastavenej pre pacienta, tzv. «liečby ušitej na mieru»), ktorá je výsledkom najnovších diagnostických testov a analýz zdravotného stavu pacienta i jeho ochorenia.
Personalizovaná terapia predstavuje najvyšší možný individuálny prístup v liečbe a manažmente pacienta s onkologickým ochorením.
Jej najväčšou výhodou je, že odstraňuje nežiaduce účinky a nedostatočnú účinnosť bežnej chemoterapie, či rádioterapie založenej na všeobecných liečebných protokoloch určených pre vybranú skupinu pacientov s podobným ochorením. Takáto liečba však nezohľadňuje úplne individualitu pacienta, jeho imunitného systému, metabolického stavu a profil biologických vlastností ochorenia, ktoré nie sú vždy dostatočne podrobne analyzované bežnými testami používanými v klinickej praxi.
Využitím personalizovanej terapie prinášame našim klientom možnosť získať najlepšiu dostupnú liečbu ich onkologického ochorenia. Znižujeme riziko nežiaducich účinkov nešpecifickej chemoterapie a prinášame možnosť podstúpiť individuálnu, personalizovanú liečbu pacientom s onkologickým ochorením.
Tradičným spôsobom liečby onkologického pacienta je v prípade indikácie podávanie chemoterapie. Jedná sa o liečebné látky, tzv. cytostatiká, ktoré obvykle zabíjajú všetky rýchlo sa deliace bunky v tele pacienta narušením bunkového delenia či procesu smrti buniek. Žiaľ, takýto spôsob liečby, založený na kombinácii jedného či viacerých cystostatík podľa štandardných protokolov (t.j. kombinácii liekov a režimov ich podávania) vedie často k mnohým vedľajším účinkom a nezohľadňuje úplne individuálne charakteristiky pacienta, čo sa prejaví recidívou ochorenia. Na druhej strane, cielená liečba rakoviny predstavuje použitie takých liekov, ktoré sú presne indikované pre konkrétneho pacienta s určitým typom, vlastnosťami ochorenia na základe ktorých sú tieto látky určené na cielené zasahovanie do špecifických molekúl alebo molekulových dráh, bunkových procesov zastavujúcich rast a progresiu nádoru.

Primárnym cieľom cielenej, individuálne nastavenej personalizovanej terapie je efektívne pôsobiť len proti rakovinovým bunkám a čo najmenej ovplyvniť nenádorové bunky, t.j. nespôsobiť podávanou liečbou vedľajšie účinky.
O význame vykonania testov pre potrebu personalizovanej liečby svedčí i skutočnosť, že už v roku 2017 až 76% onkológov v USA využívalo NGS (Next Generation Sequencing) analýzy ochorenia pre správne individuálne nastavenie liečby pacienta (3), pričom 60.1% z nich bolo veľmi spokojných s možnosťou využitia takéhoto testovania v personalizovanej liečbe (4).
Je totiž dokázané, že pacienti, ktorým sa vykoná genomická analýza potrebná pre personalizovanú liečbu, majú oveľa dlhšie obdobie bez príznakov ochorenia (bez recidívy) ako aj celkové prežívanie než pacienti u ktorých takéto testy neboli vykonané (5).
Toto zistenie podmienilo i zmenu správania sa onkológov v praxi, kde je už bežným stavom, že až 65-70% onkológov odkladá rozhodovanie o liečbe karcinómu až do času obdržania výsledkov molekulových testov, pričom 35-40% pacientov dostane inú než prvotne plánovanú liečbu onkológom (6,7). Tieto testy zároveň môžu určiť pre koho je (neo)adjuvantná chemoterapia vhodná a pre koho už nie. Teda informáciu kedy chemoterapia neprinesie žiadny benefit z pohľadu recidívy ochorenia a prežívania, dokonca môže byť škodlivá. V praxi sa často jedná o nasledovný príklad: Onkologická liečba je po operácii podaná pacientovi, ktorý síce vykazuje vysoké riziko recidívy na základe bežne hodnotiacich klinicko-patologických parametrov, ale je neúčinná, resp. môže pacienta poškodiť, pretože pacientov nádor vykazuje genetické vlastnosti svedčiace o nízkej agresivite a rizika recidívy, a liečbu teda nie je potrebné absolvovať. V lekárskej terminológii sa označujú takéto prípady ako pacienti s tzv. „high clinical risk and low genomic risk for recidive“(8,9). Onkológovia preto považujú za dôležité implementovať takéto testovanie v rozhodovacom procese o nastavení liečby pre pacienta (10,11).

Klinické štúdie preukázali, že až u 18-22% pacientov s karcinómom prsníka bola preklasifikovaná ich klinicko-histopatologická subtypizácia na iný molekulový podtyp ochorenia, čím pacienti získali možnosť špecifickej personalizovanej liečby o ktorej sa predtým vôbec neuvažovalo, pretože ich typ malígneho ochorenia sa považoval na základe bežne vyšetrovaných parametrov za typovo iný druh karcinómu (12,13).
Táto molekulová klasifikácia následne umožňuje vybrať lepší, účinnejší typ liečby pre pacienta a zabezpečí výrazne vyšší stupeň odpovede ochorenia na liečbu (14,15). Zároveň umožní určiť, ktorí pacienti sú náchylnejší na recidívu ochorenia (16).
V niektorých krajinách je preto už samozrejmosťou využitie multidisciplinárneho odborného tímu špecialistov v oblasti personalizovanej terapie pri nastavení pacienta na jeho individuálnu liečbu (17). Výrazne im v rozhodovacom procese pomáha i dynamicky sa rozvíjajúca technológia umelej inteligencie (Artificial intelligence) umožňujúca využívať a hodnotiť výsledky tisícov štúdií a meta-analytického prístupu v systematickom hodnotení možností liečby pre onkologického pacienta (18,19).
Webové stránky:
https://www.oncotypeiq.com/en the 21‐gene Recurrence Score (RS; Oncotype DX; Genomic Health, Inc., Redwood City, CA)
https://agendia.com/mammaprint/ the 70‐gene signatures (MammaPrint and BluePrint, respectively; Agendia, Irvine, CA)
https://agendia.com/blueprint/ the 70‐gene and 80‐gene signatures (MammaPrint and BluePrint, respectively; Agendia, Irvine, CA)
https://www.prosigna.com/en/ the 50‐gene Prediction Analysis of Microarrays (PAM50) and PAM50 Risk of Recurrence (PAM50‐ROR; Prosigna; NanoString Technologies, Seattle, WA)
https://myriad-oncology.com/endopredict/ EndoPredict (Myriad Genetics, Inc., Salt Lake City, UT)
https://www.breastcancerindex.com/ Breast Cancer Index (BCI; Biotheranostics, Inc., San Diego, CA)
Watson for Oncology: https://www.youtube.com/watch?v=338CIHlVi7A
Určenie rizika vzniku ochorenia
Personalizovanú medicínu je možné využiť i v oblasti služieb klientom, ktoré sú zamerané na vyhľadávanie pacientov s vysokým rizikom vzniku ochorenia, ešte predtým ako sa karcinogenéza spustí v tele pacienta. Či už sa jedná o pacienta s rizikom hereditárneho familiárneho výskytu malígneho ochorenia v rodine, alebo o sporadické typy malígnych ochorení. V praxi ide predovšetkým o genetické testovanie, ktoré pomáha odhadnúť vašu šancu na rozvoj rakoviny počas vášho života. Analýza sa robí hľadaním špecifických zmien vo vašich génoch, chromozómoch alebo proteínoch. Tieto zmeny sa nazývajú mutácie.
Súčasne dostupné genetické testy sú určené pre nasledovné typy rakoviny:
- Rakovina prsníka
- Rakovina vaječníkov
- Rakovina hrubého čreva
- Rakovina štítnej žľazy
- Rakovina prostaty
- Rakovina pankreasu
- Melanóm
- Sarkóm
- Rakovina obličiek
- Rakovina žalúdka
Genetické testy môžu pomôcť predpovedajte riziko vzniku konkrétnej choroby (celoživotne, resp. krátkodobé, napr. 5 rokov). Je len na každom z vás, či chcete zistiť, či máte gény, ktoré môžu u vás spôsobiť vznik rakovinového ochorenia a preniesť takéto zvýšené riziko rakoviny i na vaše deti. Personalizovaná medicína vám týmto spôsobom poskytuje informácie, ktoré vám pomôžu pri vašej zdravotnej starostlivosti (20,21).

Z technického hľadiska ide pri tejto analýze predovšetkým o odhalenie individuálnej genetickej predispozície jedinca k vzniku vybraných nádorových ochorení na základe špecifických molekulových a genetických testov spojených s analýzou prípadných biologických, somatických, familiárnych a environmentálnych rizík u sledovaného subjektu. Proces analýzy rizika vzniku malígneho ochorenia je vo vybraných prípadoch doplnený o informácie z predošlých vyšetrení, napr. zobrazovacích (ultrazvuk, mamografia, CT/MR), histologických (správy od patológa) a krvných testov na tzv. tumormarkery.
https://bcrisktool.cancer.gov/
https://cancerscreen.geneplanet.com/en
Diagnostika ochorenia v čo najskoršom štádiu (liquid biopsia)
V oblasti personalizovanej medicíny ponúkame našim klientom i najnovšiu, revolučnú technológiu (tzv. Tekutá biopsia, angl. Liquid biopsy), určenú pre úplne skorú diagnostiku prítomnosti malígneho ochorenia v tele pacienta, dlho predtým než sa ochorenie klinicky prejaví, alebo bude zachytené na niektorom z diagnostických vyšetrení. Táto technológia je založená na odbere minimálneho množstva biologického materiálu od pacienta (napr. krv, očná tekutina, sliny, moc, sekrét z prsníka). Získaná vzorka sa zasiela do vybraných vysoko-špecializovaných laboratórií zameraných na molekulárnu diagnostiku nádorových ochorení.
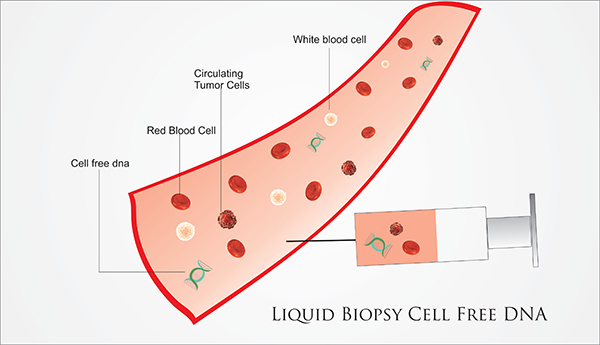
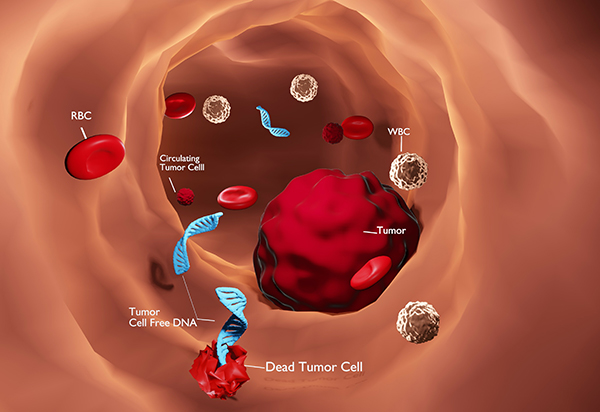
Na základe špecifických diagnostických testov v oblasti metabolomiky, genomiky a proteomiky sú vyšetrené stovky až tisícky génov, molekúl a ich vzájomné prepojenie. Z týchto výsledkov dokážeme určiť prítomnosť ochorenia v tele pacienta ešte predtým ako sa ochorenie diagnostikuje dnes bežne dostupnými vyšetreniami, ako sú napr. USG, RTG, CT, MMG, MR, krvné markery (čo býva žiaľ mnohokrát neskoro).
Pacient má zároveň možnosť v niektorých prípadoch i nepodstúpiť bolestivé odbery tkaniva bioptickou ihlou z nádoru, keďže informácie o ochorení vieme získať oveľa šetrnejším a bezpečnejším spôsobom práve pomocou technológie vyšetrenia tekutej biopsie. Využívanie tekutej biopsie v diagnostickom procese je už súčasťou starostlivosti o pacienta v mnohých vyspelých krajinách s vysokou úrovňou zdravotnej starostlivosti (22).
Sledovanie priebehu ochorenia
Najnovším trendom a budúcou perspektívou je využitie metód tekutej biopsie v oblasti sledovania pacientov po onkologickej operácii, t.j. počas podávania onkologickej liečby a po jej ukončení v období dlhodobého viacročného sledovania. V drvivej väčšine je pacient sledovaný svojim lekárom formou klinického vyšetrenia, odberov krvi na nízko špecifické nádorové markery, či testy hodnotiace vedľajšie účinky liečby, doplnené o zobrazovacie vyšetrenie (ultrazvuk, CT, PET-CT, MR). Žiaľ, nie vždy sú takéto postupy dostatočne citlivé či schopné zachytiť skoré zmeny priebehu ochorenia. Práve tu však výsledky špecifických genetických, proteomických a metabolomických testov dokážu oveľa lepšie informovať ošetrujúceho lekára o účinku / neefektívnosti podávanej chemoterapie / imunoterapie / hormonálnej liečby v porovnaní s bežným klinickým vyšetrením, (doplneným o odber krvi na tumormarkery ev. o zobrazujúce vyšetrenie pátrajúce po zmenšení nádoru, ev. návratu ochorenia vo forme metastáz).
Sledovanie správania sa ochorenia pomocou testov metód tekutej biopsie umožňuje potom oveľa skôr odhaliť, že niečo sa «deje» a zasiahnuť v liečebnom procese (zmeniť neefektívnu, nedostatočne účinnú liečbu na inú), či predpovedať návrat ochorenia mnoho mesiacov predtým, ako sa metastázy objavia na kontrolných zobrazovacích vyšetreniach, resp. sa stávajú klinicky manifestnými. Takéto zistenia dávajú pacientovi oveľa väčšiu šancu na skoršiu intervenciu zo strany ošetrujúceho lekára a tým výrazne zlepšujú jeho celkove prežívanie.
Priebeh pokročilého karcinómu vaječníka s charakteristickými početnými relapsami a terapeutickými intervenciami. Hodnotené na základe sledovania hladín tumormarkeru Ca-125 (23).
Ako diagnostika a nastavenie personalizovanej liečby funguje
1. Získanie vzorky
Nádorové tkanivo sa odoberie do špeciálneho odberového setu počas operácie, alebo sa odoberie malá časť nádoru z parafínového bločku uskladneného na oddelení patológie po operácii. (Proces odberu materiálu dohodneme s vami a vašim pracoviskom). V niektorých prípadoch však stačí odobrať iba malé množstvo vašej vzorky krvi na extrakciu DNA, mRNA potrebnej na vykonanie testov. Vzorky biologického materiálu sa zašlú do špecializovaných laboratórií na Slovensku, v EU ev. USA.
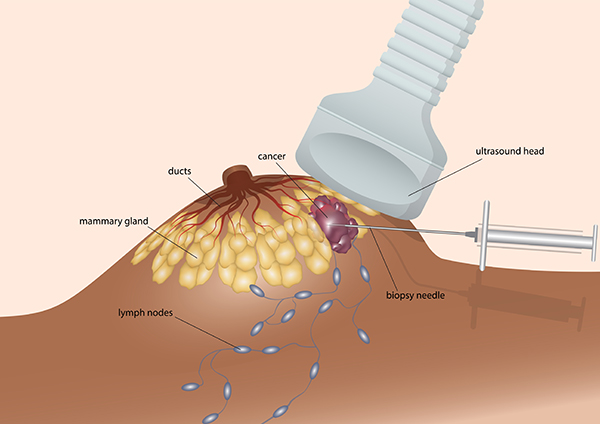
2. Analýza vzorky
Vzorky tkaniva ev. krvi sa analyzujú najmodernejšou diagnostickou technikou a vysoko sofistikovanými testami zameranými na molekulárnu diagnostikou vášho ochorenia.


3. Získanie výsledku analýz a odporúčania pre cielenú liečbu
Na základe diagnostických testov, ktoré sú zamerané na nádorové procesy vzniku, progresie, šírenia ochorenia a odpovede nádorového tkaniva na liečbu získate odbornú správu o náleze a návrhoch pre cielenú individuálnu liečbu, priamo ušitú pre vás.
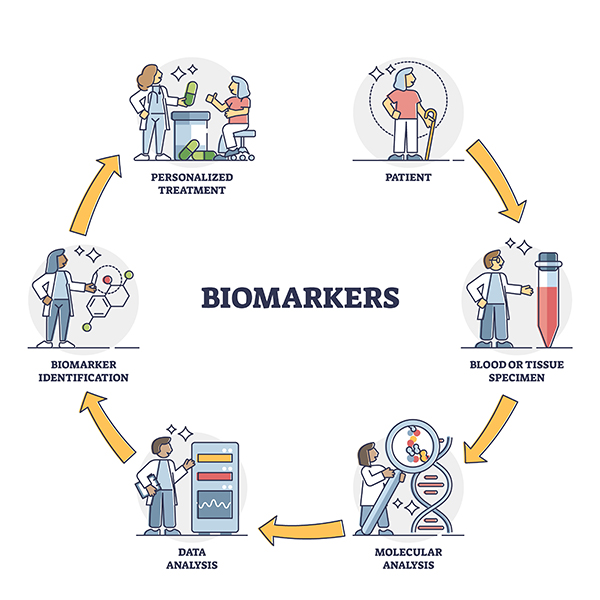
4. Konzultácia k výsledkom testov
Náš odborník v oblasti onkologickej liečby vám podrobne vysvetlí význam výsledkov diagnostických testov personalizovanej medicíny a preberie s vami navrhované možnosti cielenej liečby, ktorú v prípade potreby zašleme i vášmu ošetrujúcemu onkológovi.

Literatúra:
- Mathur S, Sutton J. Personalized medicine could transform healthcare. Biomed Rep. 2017 Jul;7(1):35.doi:10.3892/br.2017.922.;https://www.ncbi.nlm.nih.gov/pmc/articles/PMC54927/.
- AmericanCancerSociety.Precisionorpersonalizedmedicine. https://www.cancer.org/treatment/treatments-and-side-effects/treatment-types/precision-medicine.html; Personalizovana liecba zachranuje zivoty pacientov (Aspinall MG, Hamermesh RG. Realizing the Promise of Personalized Medicine. Harvard Bussines Review. October 2007; https://hbr.org/2007/10/realizing-the-promise-of-personalized-medicine.
- Freedman AN, Klabunde CN, Wiant K, Enewold L, Gray SW, Filipski KK, Keating NL, Leonard DGB, Lively T, McNeel TS, Minasian L, Potosky AL, Rivera DR, Schilsky RL, Schrag D, Simonds NI, Sineshaw HM, Struewing JP, Willis G, de Moor JS. Use of Next-Generation Sequencing Tests to Guide Cancer Treatment: Results From a Nationally Representative Survey of Oncologists in the United States. JCO Precis Oncol. 2018 Nov;2:1-13.doi: 10.1200/PO.18.00169. https://pubmed.ncbi.nlm.nih.gov/35135159/.
- de Moor JS, Gray SW, Mitchell SA, Klabunde CN, Freedman AN. Oncologist Confidence in Genomic Testing and Implications for Using Multimarker Tumor Panel Tests in Practice. JCOPrecisOncol.2020Jun11;4:PO.19.00338.doi:10.1200/PO.19.00338. https://pubmed.ncbi.nlm.nih.gov/32923869/.
- Choucair K, Mattar BI, Van Truong Q, Koeneke T, Van Truong P, Dakhil C, Cannon MW, Page SJ, Deutsch JM, Carlson E, Moore DF, Nabbout NH, Kallail KJ, Dakhil SR, Reddy PS. Liquid Biopsy-based Precision Therapy in Patients with Advanced Solid Tumors: A Real-world Experience from a Community-based Oncology Practice. Oncologist.2022Mar11;27(3):183-190.doi:10.1093/oncolo/oyac007.https://pubmed.ncbi.nlm.nih.gov/35274713/.
- Zhu X, Dent S, Paquet L, Zhang T, Tesolin D, Graham N, Aseyev O, Song X. How Canadian Oncologists Use Oncotype DX for Treatment of Breast Cancer Patients. Curr Oncol. 2021 Feb 4;28(1):800-812.doi:10.3390/curroncol28010077. https://pubmed.ncbi.nlm.nih.gov/33557029/;
- Assi HI, Alameh IA, Khoury J, Abdul Halim N, El Karak F, Farhat F, Berro J, Sbaity E, Charafeddine M, Tfayli A, Salem Z, El Saghir N. Impact of Commercialized Genomic Tests on Adjuvant Treatment Decisions in Early Stage Breast Cancer Patients. J Oncol. 2020 Nov 28;2020:9238084. doi: 10.1155/2020/9238084. https://pubmed.ncbi.nlm.nih.gov/33312202/.
- Green N, Al-Allak A, Fowler C. Benefits of introduction of Oncotype DX® testing. Ann R CollSurgEngl.2019Jan;101(1):55-59.doi:10.1308/rcsann.2018.0173. https://pubmed.ncbi.nlm.nih.gov/30322288/;
- Piccart M, van ‘t Veer LJ, Poncet C, Lopes Cardozo JMN, Delaloge S, Pierga JY, Vuylsteke P, Brain E, Vrijaldenhoven S, Neijenhuis PA, Causeret S, Smilde TJ, Viale G, Glas AM, Delorenzi M, Sotiriou C, Rubio IT, Kümmel S, Zoppoli G, Thompson AM, Matos E, Zaman K, Hilbers F, Fumagalli D, Ravdin P, Knox S, Tryfonidis K, Peric A, Meulemans B, Bogaerts J, Cardoso F, Rutgers EJT. 70-gene signature as an aid for treatment decisions in early breast cancer: updated results of the phase 3 randomised MINDACT trial with an exploratory analysis by age. Lancet Oncol. 2021 Apr;22(4):476-488.doi:10.1016/S1470-2045(21)00007-3. https://pubmed.ncbi.nlm.nih.gov/33721561/.
- Domchek SM, Mardis E, Carlisle JW, Owonikoko TK. Integrating Genetic and Genomic Testing Into Oncology Practice. Am Soc Clin Oncol Educ Book. 2020 May;40:e259-e263. doi: 10.1200/EDBK_280607. https://pubmed.ncbi.nlm.nih.gov/32453613/;
- Thavaneswaran S, Ballinger M, Butow P, Meiser B, Goldstein D, Lin F, Napier C, Thomas D, Best M. The experiences and needs of Australian medical oncologists in integrating comprehensive genomic profiling into clinical care: a nation-wide survey. Oncotarget. 2021 Oct12;12(21):2169-2176.doi:10.18632/oncotarget.28076. https://pubmed.ncbi.nlm.nih.gov/34676049/.
- Whitworth P, Beitsch P, Mislowsky A, Pellicane JV, Nash C, Murray M, Lee LA, Dul CL, Rotkis M, Baron P, Stork-Sloots L, de Snoo FA, Beatty J. Chemosensitivity and Endocrine Sensitivity in Clinical Luminal Breast Cancer Patients in the Prospective Neoadjuvant Breast Registry Symphony Trial (NBRST) Predicted by Molecular Subtyping. Ann Surg Oncol. 2017 Mar;24(3):669-675.doi:10.1245/s10434-016-5600-x. https://pubmed.ncbi.nlm.nih.gov/27770345/.
- Whitworth P, Stork-Sloots L, de Snoo FA, Richards P, Rotkis M, Beatty J, Mislowsky A, Pellicane JV, Nguyen B, Lee L, Nash C, Gittleman M, Akbari S, Beitsch PD. Chemosensitivity predicted by BluePrint 80-gene functional subtype and MammaPrint in the Prospective Neoadjuvant Breast Registry Symphony Trial (NBRST). Ann Surg Oncol. 2014 Oct;21(10):3261-7.doi:10.1245/s10434-014-3908-y. https://pubmed.ncbi.nlm.nih.gov/25099655/.
- Beitsch P, Whitworth P, Baron P, Rotkis MC, Mislowsky AM, Richards PD, Murray MK, Pellicane JV, Dul CL, Nash CH, Stork-Sloots L, de Snoo F, Untch S, Lee LA. Pertuzumab/Trastuzumab/CT Versus Trastuzumab/CT Therapy for HER2+ Breast Cancer: Results from the Prospective Neoadjuvant Breast Registry Symphony Trial (NBRST). Ann SurgOncol.2017Sep;24(9):2539-2546.doi:10.1245/s10434-017-5863-x.https://pubmed.ncbi.nlm.nih.gov/28447218/.
- Pease AM, Riba LA, Gruner RA, Tung NM, James TA. Oncotype DX® Recurrence Score as a Predictor of Response to Neoadjuvant Chemotherapy. Ann Surg Oncol. 2019 Feb;26(2):366-371.doi:10.1245/s10434-018-071078. https://pubmed.ncbi.nlm.nih.gov/30542840/.
- Sestak I, Buus R, Cuzick J, Dubsky P, Kronenwett R, Denkert C, Ferree S, Sgroi D, Schnabel C, Baehner FL, Mallon E, Dowsett M. Comparison of the Performance of 6 Prognostic Signatures for Estrogen Receptor-Positive Breast Cancer: A Secondary Analysis of a Randomized Clinical Trial. JAMA Oncol. 2018 Apr 1;4(4):545-553. doi: 10.1001/jamaoncol.2017.5524. https://pubmed.ncbi.nlm.nih.gov/29450494/.
- Hoefflin R, Geißler AL, Fritsch R, Claus R, Wehrle J, Metzger P, Reiser M, Mehmed L, Fauth L, Heiland DH, Erbes T, Stock F, Csanadi A, Miething C, Weddeling B, Meiss F, von Bubnoff D, Dierks C, Ge I, Brass V, Heeg S, Schäfer H, Boeker M, Rawluk J, Botzenhart EM, Kayser G, Hettmer S, Busch H, Peters C, Werner M, Duyster J, Brummer T, Boerries M, Lassmann S, von Bubnoff N. Personalized Clinical Decision Making Through Implementation of a Molecular Tumor Board: A German Single-Center Experience. JCO Precis Oncol. 2018 Aug16;2:PO.18.00105.doi:10.1200/PO.18.00105. https://pubmed.ncbi.nlm.nih.gov/32913998/.
- Jie Z, Zhiying Z, Li L. A meta-analysis of Watson for Oncology in clinical application. Sci Rep.2021Mar11;11(1):5792.doi:10.1038/s41598-021-84973-5. https://pubmed.ncbi.nlm.nih.gov/33707577/.
- Kim MS, Park HY, Kho BG, Park CK, Oh IJ, Kim YC, Kim S, Yun JS, Song SY, Na KJ, Jeong JU, Yoon MS, Ahn SJ, Yoo SW, Kang SR, Kwon SY, Bom HS, Jang WY, Kim IY, Lee JE, Jeong WG, Kim YH, Lee T, Choi YD. Artificial intelligence and lung cancer treatment decision: agreement with recommendation of multidisciplinary tumor board. Transl Lung CancerRes.2020Jun;9(3):507-514.doi:10.21037/tlcr.2020.04.11. https://pubmed.ncbi.nlm.nih.gov/32676314/.
- Pashayan N, Antoniou AC, Ivanus U, Esserman LJ, Easton DF, French D, Sroczynski G, Hall P, Cuzick J, Evans DG, Simard J, Garcia-Closas M, Schmutzler R, Wegwarth O, Pharoah P, Moorthie S, De Montgolfier S, Baron C, Herceg Z, Turnbull C, Balleyguier C, Rossi PG, Wesseling J, Ritchie D, Tischkowitz M, Broeders M, Reisel D, Metspalu A, Callender T, de Koning H, Devilee P, Delaloge S, Schmidt MK, Widschwendter M. Personalized early detection and prevention of breast cancer: ENVISION consensus statement. Nat Rev Clin Oncol. 2020; 17(11): 687–705. Published online 2020 Jun 18. doi: 10.1038/s41571-020-0388-9.Correctionin: NatRevClinOncol.2020;17(11):716.https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7567644/.
- Robson ME, Bradbury AR, Arun B, Domchek SM, Ford JM, Hampel HL, Lipkin SM, Syngal S, Wollins DS, Lindor NM. American Society of Clinical Oncology Policy Statement Update: Genetic and Genomic Testing for Cancer Susceptibility. J Clin Oncol. 2015; 33(31):3660-3667,http://acmgen.org/wp-content/uploads/2017/04/Genetic-and-genomic-testing-for-cancer-susceptibility-ASCO-2015.pdf.
- Kamps R, Brandão RD, Bosch BJ, Paulussen AD, Xanthoulea S, Blok MJ, Romano A. Next-Generation Sequencing in Oncology: Genetic Diagnosis, Risk Prediction and Cancer Classification. Int J Mol Sci. 2017 Jan 31;18(2):308. doi: 10.3390/ijms18020308. https://pubmed.ncbi.nlm.nih.gov/28146134/.
- du Bois A, Pfisterer J. Primärtherapie des Ovarialkarzinoms [First-line therapy in ovarian cancer]. Zentralbl Gynakol. 2004 Oct;126(5):312-4. German. doi: 10.1055/s-2004-820390.

